

 |
 |
 |
March 31, 2006 |
|---|
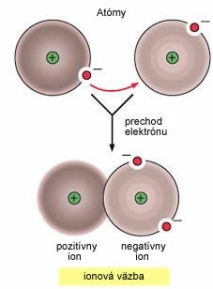
Chemické väzbyChemická väzba je spojenie alebo interakcia dvoch alebo viacerých atómov, pričom vznikajú stabilnejšie systémy ako napr. Molekula. Je to spôsobené rozdielom energií v stave samotného atómu a molekuly. Ako molekula má systém nižšiu celkovú energiu ako pri samotnom atóme.
V roku 1916, Americký chemik Gilbert Newton Lewis poukázal na to že chemická väzba medzi atómami nastáva v tedy ked elektróny týchto atómov spolu interagujú. Lewis tak isto pozoroval to že prvky sú najstabilnejšie práve vtedy keď majú doplnený oktet (majú 8 elektrónov vo svojej valenčnej vrstve) Iónová väzba |
||
|
 |
|
Kovalentná väzba Je typ chemickej väzby, ktorá vzniká medzi dvoma atómami, ktoré majú jeden alebo viac nespárených elektrónov a ich rozdiel elektronegativít je malý. Kovalentná väzba je silnejšia ako vodíková väzba a je približne rovnako silná ako iónová väzba. |
||
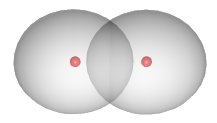 |
Pri tvorení väzby sa elektrónové oblaky nespárených elektrónov navzájom prekryjú a splynú. Spoločný elektrónový oblak sprostredkuje väzbu medzi atómami. Tým si atómy doplnia počet elektrónov zvyčajne na taký, aký majú atómy najbližšieho vzácneho plynu v periodickej tabuľke. |
|
Napríklad zlúčením dvoch atómov vodíka vzniká molekula vodíka H2, v ktorej je spoločný dvojelektrónový orbitál patriaci obidvom atómom. Pri vodíku sa prekrývajú dva orbitály typu s (s—s). Oba atómy majú potom taký elektrónový obal ako atóm najbližšieho vzácneho plynu - hélia. Podobne môže vzniknúť väzbový molekulový orbitál prekrytím a splynutím jednoelektrónových orbitálov p—p, ako je to napríklad pri zlučovaní dvoch atómov chlóru na molekulu Cl2. Splynutím jedného orbitálu s a jedného orbitálu p môže vzniknúť napríklad kovalentná väzba medzi vodíkom a chlórom - vzniká chlorovodík (HCl). |
||
Lewisov zápis |
|
|
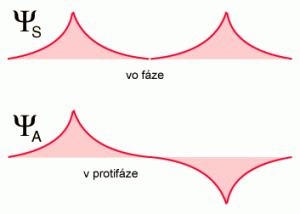
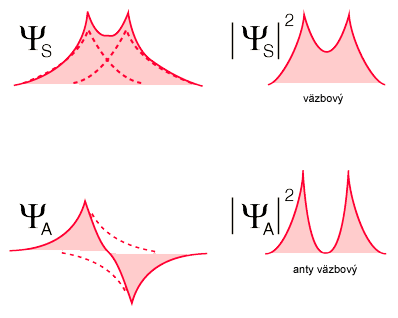
Ak je elektronegativita obidvoch atómov rovnaká, ťažisko elektrónového oblaku je uprostred medzi atómami (nepolárna, homeopolárna väzba napr. H2). Pri rozdielnej elektronegativite zlúčených atómov je ťažisko väzbového orbitálu elektrónového oblaku posunuté k atómu elektronegativnejšieho prvku (napr. HCl). Kovalentná väzba tohto typu sa volá polárna kovalentná väzba, alebo hovoríme o iónovom charaktere kovalentnej väzby Podobný typ je Koordinačná čiže donorno-akceptorná väzba je kovalentná väzba, ktorú utvorí voľný elektrónový pár jedného atómu (donora), jeho oblak vyplní aj prázdny (vakantný) orbitál druhého atómu (akceptora). Objav kovalentnej väzby sa pripisuje Gilbertovi Lewisovi, ktorý v roku 1916 opísal poskytovanie elektrónového páru medzi atómami. Predstavil Lewisov zápis alebo Elektrónový bodový zápis, v ktorom sú valenčné elektróny (vo vonkajšej elektrónovej vrstve atómu) zakreslené ako body okolo atómu. Páry elektrónov nachádzajúce sa medzi atómami predstavujú kovalentné väzby. Viacnásobné páry reprezentujú viacnásobné väzby - dvojitú alebo trojitú. Pre pochopenie kovalentnej väzby je potrebné poznať kvantovú mechaniku. Walter Heitler a Fritz London ako prví v roku 1927 úspešne popísali kvantovo-mechanický model kovalentnej väzby v molekule vodíka. Ich práca bola založená na valenčných väzbových modeloch, Prekrývanie (interferencia) orbitálov ktoré môžu byť vo fáze alebo v protifáze. Ak reagujú atómové orbitály vo fáze vzniká väzbový orbitál ak v protifáze vzniká anty-väzbový orbitál |
 |
 |
Page design by Martin Halmo |