Vodík je najjednoduchší chemický prvok vôbec, je číry bezfarebný plyn bez chuti a zápachu. Je najľahší plyn vôbec (14 krát ľahší jako vzduch). Molekulárny vodík je pomerne stabilný. Pohybuje sa obrovskou rýchlosťou 1800 m/s. Jeho tepelná vodivosť je sedemkrát väčšia ako vzduchu. Molekuly sú extrémne malé a preto ľahko prechádzajú poréznymi látkami.
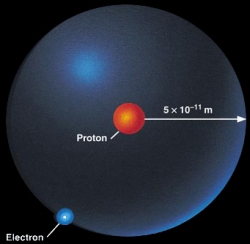
Patrí mu prvenstvo v periodickej tabuľke, má jeden protón a jeden elektrón. Jeho elektrónový obal pozostáva z jednej vrstvy a to (1s1). Prvky ktoré sú v skupine pod ním majú tak isto valenčnú vrstvu (s) s jedným elektrónom.
Vodík je za normálnych podmienok bezfarebný horľavý plyn (s kyslíkom tvorí traskavú zmes). Dá sa skvapalniť a dokonca aj stužiť kedy sa vlastnosťami podobá na ľad.
Jeho elekronegativita je 2,2 ; vytvára dvoj atómovú molekulu H2 kedy dosiahne oktet (zaplní si valenčný orbitál s)
V zlúčeninách:
Okrem dvoj atómovej zlúčeniny H2 vytvára hydridové anióny H- keď sa viaže s elektro menej negatívnymi prvkami (hydridy alkalických kovov a kovov alk. zemín napr. NaH)
Tak isto dokáže tvoriť aj H+ katióny ( no energia na odtrhnutie elektrónu je ale veľmi vysoká ) stretneme sa s ním v molekule H3O+
Nachádza sa aj v kovalentných väzbách s halovými prvkami kde vytvára silne polárne kovalentné väzby HF. (reakcia s F a Cl je veľmi búrlivá, zlučuje sa okamžite)
Koordinačné väzby vytvára v tzv. vodíkových mostíkoch, sú to slabé kovalentné väzby (asi 10x slabšie ako bežné kov.v.)
Využitie
Vodík má rad významných využití. Ako napríklad postavenie vo výrobe rôznych chemických zlúčenín (amoniak – NH3, kyselina dusičná – HNO3, metylalkohol –CH3OH, rôzne dusíkaté hnojivá), výroba niektorých kovov (redukciou z iných oxidov) alebo stužovanie tukov.
Prv sa používal ku zváraniu a rezaniu kovov (kyslíkovým plameňom). Naďalej sa využíva v zmiešanom pomere s dusíkom ako ochranná atmosféra pri vypaľovaní polotovarov práškovej metalurgie Tekutý vodík sa používa ako raketové palivo, ale môže byť zdrojom energie i pre iné zariadenia. Vodík sa prepravuje a uchováva v oceľových fľašiach označených červeným pruhom.
Výroba
Laboratórna príprava:
V laboratóriu sa môže vodík pripravovať reakciou neušľachtilých kovov s kyselinami alebo hydroxidov v tzv. Kippovom prístroji
Zn + 2HCl = ZnCl2 + H2
Zn + 2NaOH + 2H2O -> Na2 [Zn(OH)4] + H2
Ďalej môžeme vodík získať elektrolýzou vody, ktorá obsahuje malé množstvo H2SO4 alebo NaOH pre zvýšenie vodivosti. Elektrolýza sa uskutočňuje v Hoffmanovom prístroji, kde sa vodík vylučuje na katóde.
2H3O+ + 2e- = 2H2O + H2
2Na + 2H2O = 2NaOH + H2
3Fe + 4H2O = Fe3O4 + 4H2
Priemyselná výroba
Priemyselne sa môže vodík tak ako v laboratóriu vyrábať niekoľkými rôznymi metódami.
1. Metódou je termický rozklad metánu pri veľmi vysokej teplote (1200 °C):
CH4 - C + 2H2
2. Reakciou vodného plynu s vodnou parou za prítomnosti katalyzátorov a pri teplote 300 °C môžeme získať veľmi čistý vodík, ktorý sa používa napríklad k
stuhovaniu :CO + H2 + H2O(g) = CO2 + 2H2
3. Reakcia vodnej pary s horúcim koksom za teploty 1000 °C :
C(s) + H2O(g) = CO(g) + H2(g)
4. Vznik vodíka ako vedľajší produkt pri výrobe hydroxidu sodného (NaOH) –
elektrolýza vodného roztoku NaCl: 2NaHgn + 2H20 = 2NaOH + H2 + 2nHg
Výskyt
Vodík je najrozšírenejším prvkom v celom vesmíre a tretí najrozšírenejší na Zemi. Vyskytuje sa voľne, aj viazaný v zlúčeninách. Voľný vodík sa nachádza napríklad v plynnom obale hviezd. Na Zemi sa voľný vodík pri bežných podmienkach nevyskytuje, a preto je viazaný iba v zlúčeninách. Najväčšie množstvo vodíka je viazané vo vode, ktorá pokrýva väčšinu zemského povrchu, ale je viazaný i v rôznych organických i anorganických zlúčeninách. Je to tiež významný biogénny prvok.
Izotopy
Prócium
Tiež nazývaný ľahký vodík je klasický vodík, ktorý je najviac rozšírený vo vesmíre a na Zemi. Obsahuje v atóme jeden protón a jeden elektrón. Neobsahuje neutrón v atómovom jadre.
Deutérium
Používa sa aj názov ťažká voda. Nepodlieha rádioaktívnej premene, v prírode sa bežne vyskytuje. Na 6 500 atómov pripadne jeden atóm deutéria. Jadro deutéria sa volá deuterón - je súčasťou molekuly ťažkej vody D2O.
Má významné využitie v jadrovom priemysle. Je veľmi účinným moderátorom (látkou spomaľujúcou rychlosť neutrónov).
Štruktúra atómu: 1 protón, 1 neutrón, 1 elektrón
Trícium
Jadro trícia je nestabilné a rozpadá sa s polčasom rozpadu 12,4 roka pri vyžiarenia malého množstva energetického beta žiarenia. Vzniká účinkom kozmického žiarenia na atóm deutéria alebo výbuchom vodíkovej bomby. Používa sa napríklad na značkovanie organických látok pri výskumoch.
Štruktúra atómu: 1 protón, 2 neutróny, 1 elektrón
|




